反相色谱中核酸分析技巧
反义寡核苷酸(ASO)、小干扰核糖核酸(siRNA)、核酸适配体(Aptamer)等的核酸药物一般以低聚核苷酸(寡核苷酸)作为药效实体,是继小分子药物、抗体药品之后被广为期待的新一代药。为了使易被体内降解的寡核苷酸用于医药品,开发出了经过硫化等化学修饰的寡核苷酸。
寡核苷酸的反相分离一般需使用离子对试剂。此处介绍了使用反相离子对色谱分离含修饰型核酸在内的寡核苷酸的方法。
使用反相离子对色谱(LC-MS)进行的寡核苷酸分离
离子对试剂的种类及浓度比较
该案例通过离子对试剂的种类与浓度以及有机溶剂的组合分析,对分离度和LC-MS灵敏度进行了比较。UV谱图(红色标识)的结果显示,无论流动相的种类是何种,都可通过调整梯度斜率获得良好的保留和分离。ESI-MS的强度(橙色标识)明显受到了离子对试剂种类与浓度的影响,其中HFIP-TEA/甲醇条件时获得的灵敏度最高。
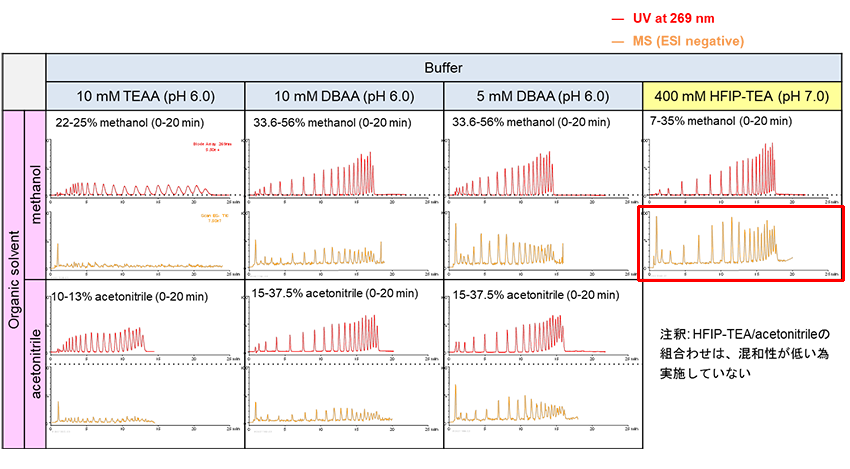
| Column | Hydrosphere C18 (3 µm, 12 nm) 50 X 2.0 mmI.D. |
|---|---|
| Flow rate | 0.2 mL/min |
| Temperature | 35ºC |
| Detection | UV at 269 nm (red), ESI negative mode (orange) |
| Injection | 5 µL (25 pmol/mL) |
| Sample | Oligodeoxythymidylic acid [p(dT)2-20] |
| eluent abbreviations | |
| TEAA |
triethylammonium acetate |
|---|---|
| DBAA |
di-n-butylammonium acetate |
| HFIP |
1,1,1,3,3,3-hexafluoro-2-propanol |
| TEA |
triethylamine |
TEA-HFIP浓度的影响
以14-21mer RNA的分离为例,在TEA-HFIP的体系下考察TEA和HFIP的浓度对分离结果的影响。首先将TEA浓度从1 mM改为4 mM(a,b)时保留时间大约延长至2倍,再将HFIP浓度从50 mM调整至100 mM(b,c)时保留时间会进一步增加到1.5倍。由此可以看出,离子对试剂和HFIP的浓度均会影响分离与保留时间。
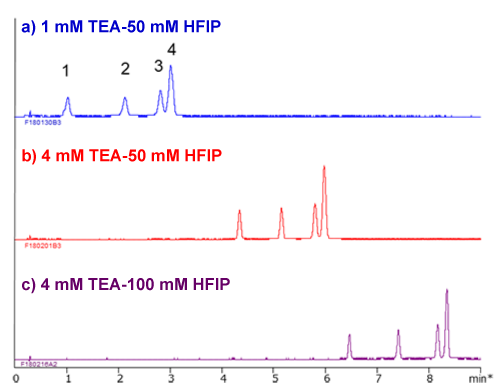
RNA sample
- 5'-CAC UGA AUA CCA AU-3' (14 mer)
- 5'-UCA CAC UGA AUA CCA AU-3' (17 mer)
- 5'-UCA UCA CAC UGA AUA CCA AU-3' (20 mer)
- 5'-GUC AUC ACA CUG AAU ACC AAU-3' (21 mer)
| Column | YMC-Triart C18 (1.9 µm, 12 nm) 50 X 2.1 mmI.D. |
|---|---|
| Eluent | A) Buffer, B) methanol 5-15%B (0-10 min) |
| Flow rate | 0.42 mL/min |
| Temperature |
65°C |
| Detection | UV at 260 nm |
| Injection |
1.0 µL (2-4 nmol/mL) |
修饰型寡核苷酸的分离
寡核苷酸的磷酸根上的氧原子被硫取代的硫代磷酸型寡核苷酸等修饰型核苷酸具有疏水性增强的趋势,因此常常会担心填料的过强吸附。另外,具有金属配位性的磷酸根也可能会成为峰形不佳的原因。基于此,在修饰型寡核苷酸的分离中,适于选用弱疏水性的色谱柱(C8或大孔色谱柱等)和无金属色谱柱。
硫代磷酸型寡核苷酸
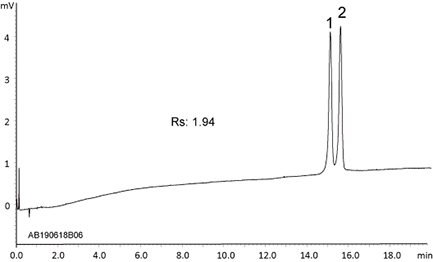
- 5’-U^C^A^U^C^A^C^A^C^U^G^A^A^U^A^C^C^A^A^U-3’
(RNA 20 mer All PS ) - 5’-G^U^C^A^U^C^A^C^A^C^U^G^A^A^U^A^C^C^A^A^U-3’
(RNA 21 mer All PS )
| Column | YMC-Triart C8 [メタルフリーカラム] (1.9 µm, 12 nm) 100 X 2.1 mmI.D. |
|---|---|
| Eluent | A) 15 mM triethylamine-400 mM HFIP* B) methanol 10-20%B (0-20 min), 10%B (20-30 min) |
| Flow rate | 0.42 mL/min |
| Temperature |
70°C |
| Detection | UV at 260 nm |
| Injection |
1 µL (each 1.25 nmol/mL) |
导入二硫单元的硫代磷酸型寡核苷酸(Disulfide-modified oligonucleotides)
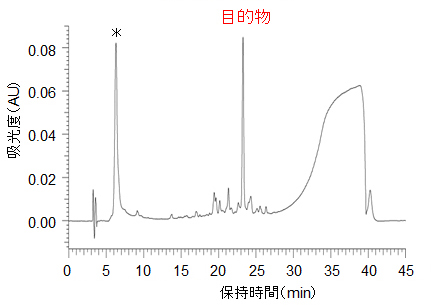
*未导入二硫单元的硫代磷酸型寡核苷酸
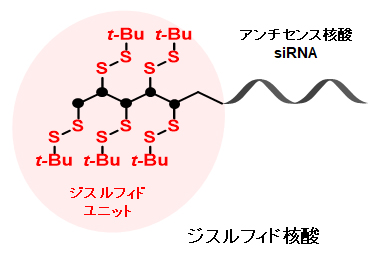
| Column | YMC-Triart Bio C4 (5 µm, 30 nm) 250 X 4.6 mmI.D. |
|---|---|
| Eluent | A) 50 mM TEAA* (pH 7.0)/acetonitrile (95/5) B) acetonitrile 5-95%B (0-30 min), 95%B (30-35 min), 95-5%B (35-35.1 min), 5%B (35.1-45 min) |
| Flow rate | 1 mL/min |
| Temperature |
50°C |
| Detection | UV at 260 nm |
| Sample | crude reaction mixture |
Courtesy of Saki Kawaguchi, Chemistry Department, Nagoya University, Japan
使用变性HPLC分析双链siRNA
本案例使用有机杂化硅胶色谱柱YMC-Triart C18对双链siRNA采用两种不同流动相条件(离子对种类与有机溶剂种类等)进行分析,同时比较了不同温度(30~60℃)下的结果。
可以发现对于条件A与B,伴随柱温的升高,峰形有改善趋势且与临近杂质的分离亦有改善趋势。诸如DNA、RNA之类的高分子化合物,通过升高温度,可改善溶质的移动速度,进而改善峰形与分离度。
虽然在条件A的所有温度与条件B的30℃时检测出的双链RNA均为单峰,但是在条件B下40℃及以上温度时,双链RNA在色谱柱内发生变性解旋成单链由此检测到两个峰。诸如此类高温条件下双链变性成单链的变性HPLC(Denaturing HPLC)在基因变异解析等方面有广泛的应用。
在条件A与条件B的分析结果对比中可以看到,相同温度下存在未变性状态与变性状态的差异,说明双链DNA或RNA的变性除与温度有关外,还受盐的离子强度(种类、浓度)、pH、溶剂极性等的影响。在实际分析中应根据分析对象与目的(是否需要分析变性状态),对柱温、流动相条件进行优化。
当需要进行高温条件探讨时,由于常规反相硅胶基质的耐久性不佳,因此推荐考虑如Triart C18这样的有机杂化硅胶色谱柱。
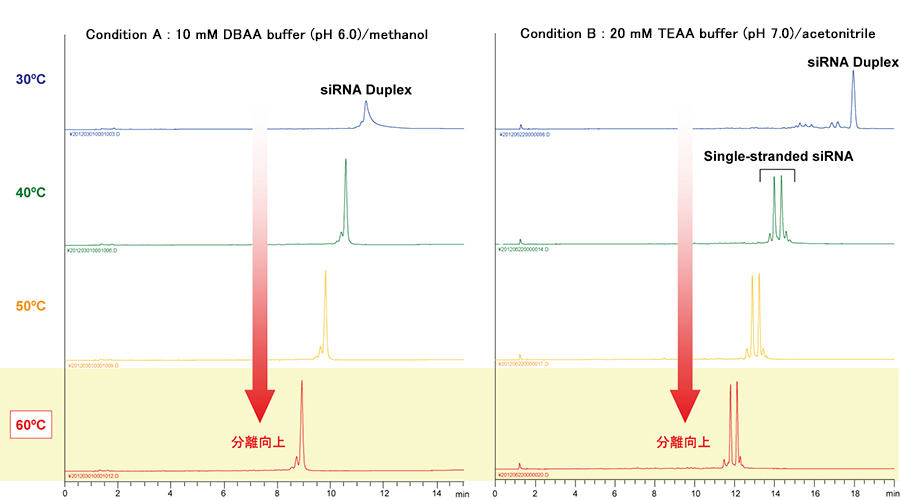
| Column | YMC-Triart C18 (1.9 µm, 12 nm) 100 X 2.0 mmI.D. |
Condition A | Eluent | A) 10 mM di-n-buthylammonium acetate (pH 6.0)
B) methanol |
|---|---|---|---|---|
| Flow rate | 0.2 mL/min | 35-60%B (0-15 min) | ||
| Detection | UV at 269 nm | Condition B | Eluent | A) 20 mM triethylammonium acetate (pH 7.0) |
| Injection | 1 µL (5 nmol/mL) | B) acetonitrile | ||
| 5-12%B (0-20 min) |

